Путешествие в захватывающий мир химических соединений начинается с углекислого газа. Разгадывая тайны его состава, мы приближаемся к пониманию не только науки, но и самой природы. Молекула СО2 оказывается фантастически сложной и загадочной, и каждый ее компонент дарит нам новые знания и возможности. Столь важное вещество влияет на нашу жизнь и окружающую среду весьма сильно, поэтому необходимо разобраться в том, что скрывается за ее поверхностной простотой.
Согласно научным исследованиям, структура СО2 состоит из трех элементов - углерода и двух атомов кислорода. Как же эти атомы взаимодействуют между собой? Один атом кислорода соединен с углеродом двойной связью, что придает молекуле особую устойчивость и необычное свойство растворяться в воде. Второй атом кислорода, в свою очередь, связан с углеродом одинарной связью, создавая уникальный баланс и энергетическую структуру СО2.
Углерод, также известный как "второй жизненный элемент", является ключевым компонентом углекислого газа. Он обладает невероятной способностью вступать в химические реакции и образовывать многочисленные соединения, делая его неотъемлемой частью органического мира. В молекуле СО2 углерод играет особую роль, в ней он между атомами кислорода структурно и энергетически связан, создавая уникальную молекулярную формулировку.
Структура молекулы СО2: атомы и бонды
Раздел посвящен изучению основных составляющих молекулы СО2, а именно ее структуре, которая определяется атомами и бондами между ними.
Молекула СО2 состоит из трех атомов - двух атомов кислорода (О) и одного атома углерода (С), которые связаны между собой определенным образом. Бонды, или химические связи, между атомами определяют структуру молекулы и взаимодействие между ее составляющими частями.
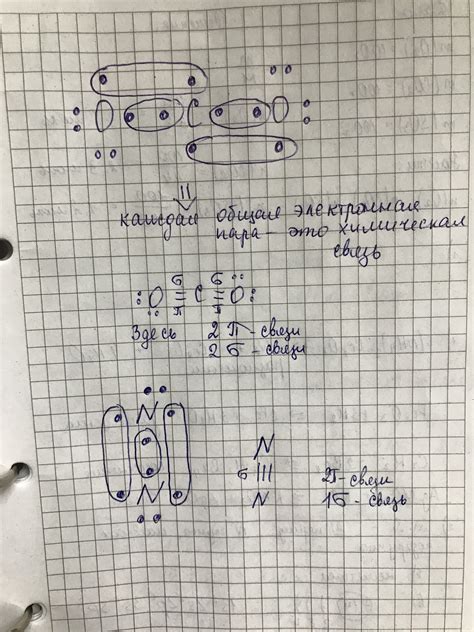
Атомы кислорода и углерода в молекуле СО2 соединены двумя двойными связями, образуя треугольную форму. Углеродный атом находится в центре этого треугольника, а атомы кислорода располагаются симметрично относительно него. Такая структура обусловлена различной электроотрицательностью атомов, что приводит к образованию полярной молекулы.
Бонды между атомами в молекуле СО2 представляют собой ковалентные связи, в которых электроны общаются между атомами и образуют пары. В данном случае, углеродный атом делит свои электроны между атомами кислорода, образуя две связи. Каждая связь представляет собой общее использование двух электронов, один электрон от каждого атома.
Основные факты о структуре углекислого газа

Углекислый газ состоит из молекул, которые в своей структуре содержат атомы углерода и кислорода. Эта вещество обладает особыми свойствами и играет важную роль в природных процессах.
Молекула углекислого газа известна своей трехатомной структурой, то есть она состоит из трех атомов – двух атомов кислорода и одного атома углерода. Такое расположение атомов придает углекислому газу его уникальные свойства и способности.
Важно отметить, что углекислый газ обладает легкой растворимостью в воде, что дает возможность осуществления важного процесса - абсорбции и выпуска его в различных природных циклах.
Глобальный климатический эффект углекислого газа изучается в связи с его высокой концентрацией в атмосфере, которая быстро растет и является одной из главных причин глобального потепления. Это влияет на биологическую разнообразность и экологию нашей планеты.
Другим важным свойством углекислого газа является его роль в фотосинтезе. Поскольку нашей планете необходимо поддерживать жизнь, то этот процесс становится важнейшим для всех зеленых растений, которые преобразуют углекислый газ в кислород и органические вещества при помощи солнечного света.
Что образует молекулу СО2: углерод и кислород

Углерод, важный химический элемент, находит широкое применение в различных областях науки и промышленности. Он является основой для молекул органических соединений, которые составляют основу жизни на Земле. В молекуле СО2 углерод находится в центре и образует связи с двумя атомами кислорода.
Кислород, другой ключевой элемент в молекуле СО2, является необходимым для существования живых организмов. Он исполняет важную роль в процессах дыхания и синтеза энергии. В молекуле СО2 каждый атом кислорода образует связь с углеродом, создавая структуру, которая является одной из основных причин глобального потепления.
Сочетание углерода и кислорода в молекуле СО2 отличается своей стабильностью и особой химической активностью. Изучение этих компонентов молекулы СО2 позволяет лучше понять их влияние на окружающую среду и разработать стратегии для снижения выбросов этого газа.
Свойства углекислого газа: реактивность и химические связи

Реактивность углекислого газа может проявляться в его способности проникать через текучие среды, как в воду или почву. Также, этот газ способен вступать в химическую реакцию с различными веществами, например, с щелочами или оксидами металлов.
Важной особенностью углекислого газа является его химическая связь. В составе молекулы СО2 присутствуют две химические связи – двойная ковалентная связь между атомом углерода и двумя атомами кислорода. Эта связь является сильной и устойчивой, что позволяет углекислому газу быть стабильным и надежным соединением.
Взаимодействие углекислого газа с другими веществами происходит за счет его реактивности и химических связей. Одним из примеров таких реакций является активное взаимодействие СО2 с растворами щелочей и образование угольных солей, а также его влияние на кислотно-щелочной баланс в природных системах.
Электронная структура молекулы СО2

| Компонент | Описание |
|---|---|
| Углерод (C) | Является центральным атомом молекулы СО2. Имеет атомный номер 6 и электронную конфигурацию 1s2 2s2 2p2. В молекуле СО2 углерод принимает сп2-гибридизацию, образуя три эквивалентных гибридизованных орбиталя. |
| Кислород (O) | Составляет две связи с углеродом, образуя двойные связи с каждым из трех гибридизованных орбиталей углерода. У атома кислорода атомный номер 8 и электронная конфигурация 1s2 2s2 2p4. |
Таким образом, электронная структура молекулы СО2 можно описать как трехатомная система, где центральный атом углерода связан с двумя атомами кислорода с помощью двойных связей. Это основное строение, которое определяет физические и химические свойства углекислого газа и его взаимодействие с окружающей средой.
Взаимное распределение электронов в структуре углекислого газа
В данном разделе мы рассмотрим характеристики распределения электронной плотности в молекуле углекислого газа для того, чтобы лучше понять взаимодействие электронов внутри этой структуры.
Молекула углекислого газа (СО2) представляет собой трехатомную молекулу, состоящую из одного атома углерода (C) и двух атомов кислорода (O). У каждого атома присутствуют свои электронные оболочки, на которых располагаются электроны. Взаимное распределение электронов между атомами влияет на свойства и структуру молекулы СО2.
| Распределение электронной плотности | Атом углерода (C) | Атом кислорода (O) |
|---|---|---|
| Внешняя оболочка | 2 электрона | 6 электронов |
| Внутренняя оболочка | 2 электрона | 6 электронов |
Взаимодействие электронов в молекуле СО2 определяется общими правилами химии и структурой атомов. Атомы углерода и кислорода обладают определенным количеством электронов в своих оболочках, которые образуют ковалентные связи и определяют форму молекулы СО2.
Взаимодействие электронной структуры в связях молекулы СО2

В данном разделе мы рассмотрим важное свойство молекулы углекислого газа, а именно взаимодействие электронных облаков в связях между атомами углерода и кислорода. Именно эти взаимодействия определяют химические и физические свойства СО2 и ее роль в природных и промышленных процессах.
Внутри молекулы СО2 электроны, распределенные между углеродным атомом и двумя кислородными атомами, находятся в постоянном движении, создавая электрическое поле и определяя форму и структуру молекулы. Взаимодействие электронных облаков в связях между атомами происходит через обмен электронами и образование ковалентных связей. Ковалентная связь образуется, когда электроны двух атомов делятся между собой, образуя своеобразное облако, в котором они находятся.
Одна из особенностей молекулы СО2 заключается в ее линейной структуре, обусловленной расположением атомов углерода и кислорода в одной плоскости. Это влияет на взаимодействие электронной структуры в молекуле и определяет ее свойства. Взаимодействие электронных облаков обуславливает силу связей и гибкость молекулы СО2, а также ее способность взаимодействовать с другими веществами.
Понимание взаимодействия электронов в бондах молекулы СО2 позволяет объяснить такие свойства этого газа, как его инертность, низкую реакционную способность и устойчивость к изменениям условий. Кроме того, это знание имеет практическое применение в различных отраслях науки и техники, где углекислый газ играет важную роль.
Полярность молекулы СО2
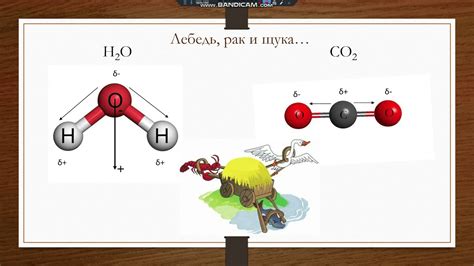
Углекислый газ (СО2) состоит из атома углерода, которому сопряжены два атома кислорода. За счет особенностей строения молекулы и ее геометрии, СО2 является неполярной молекулой. То есть, внутри молекулы нет разделения зарядов, а атомы углерода и кислорода равномерно распределены вокруг общего центра.
Такое отсутствие полярности молекулы СО2 сказывается на ее свойствах и взаимодействии с другими веществами. В частности, неполярные молекулы обладают слабой растворимостью в полярных растворителях, таких как вода. Также, полярные молекулы, в отличие от неполярных, могут проявлять силы взаимодействия между собой, такие как ван-дер-ваальсовы силы.
- Неполярность молекулы СО2 обусловлена равномерным распределением зарядов в молекуле.
- Отсутствие полярности влияет на свойства и реакционную способность СО2.
- Молекула СО2 плохо растворяется в полярных растворителях и проявляет слабые межмолекулярные силы взаимодействия.
Отсутствие полярности в молекуле углекислого газа
Важно отметить, что отсутствие полярности молекулы углекислого газа имеет значительное влияние на ряд ее физических и химических свойств. Так, например, из-за отсутствия полюсов, молекулы СО2 очень слабо подвержены взаимодействию с полярными растворителями, такими как вода, что делает их слабыми электролитами.
Кроме того, отсутствие полярности молекулы СО2 является одной из причин ее низкой растворимости в воде. Поскольку вода является полярным растворителем, полюса водных молекул притягивают другие полярные молекулы, образуя гидратные оболочки вокруг них. В случае с молекулами углекислого газа возникают лишь слабые дисперсионные силы, что делает их растворимость в воде невеликой.
Таким образом, отсутствие полярности в молекуле углекислого газа обусловлено ее линейной структурой и составом, включающим только атомы углерода и кислорода. Это свойство имеет заметное влияние на ряд его физических и химических свойств, которые существенно отличаются от молекул с полюсами и дипольными моментами.
Вопрос-ответ

Каков состав молекулы углекислого газа СО2?
Молекула углекислого газа СО2 состоит из одного атома углерода (C) и двух атомов кислорода (O).
Какие атомы входят в состав молекулы углекислого газа СО2?
В молекуле углекислого газа СО2 содержатся атомы углерода (C) и атомы кислорода (O).
Сколько атомов углерода содержит молекула углекислого газа СО2?
Молекула углекислого газа СО2 содержит один атом углерода (C).
Сколько атомов кислорода встречается в молекуле углекислого газа СО2?
В составе молекулы углекислого газа СО2 присутствуют два атома кислорода (O).
Какова основная химическая формула молекулы углекислого газа СО2?
Основная химическая формула молекулы углекислого газа СО2 указывает на наличие одного атома углерода (C) и двух атомов кислорода (O).