Мастерство химика заключается в его способности точно измерить и сочетать различные реагенты, чтобы получить желаемые результаты. В химической лаборатории каждый шаг имеет значение, и ни одна деталь не может быть пренебрежена. Одним из наиболее важных элементов в эксперименте является создание раствора с определенной концентрацией. Наши учетные балансы могут показать нам путь, но внимание к деталям и сознательность - это то, что приводит к успешному результату.
Сегодня наша цель - приготовить 0.1M раствор тиосульфата натрия. Процесс начинается с взвешивания необходимого количества реагента и тщательного соблюдения каждого шага, чтобы избежать любых ошибок. Взвешивая вещество на миллиграммы, мы демонстрируем нашу приверженность точности и стабильности в нашей научной работе.
Успех не может быть достигнут без понимания: раствор, который мы готовим, является стандартом титра. Глубокий анализ и понимание химических процессов, таких как титрование и реакции окисления-восстановления, позволяют нам оценить концентрацию наших растворов и использовать их для калибровки других реакций. Если кристалы тиосульфата натрия наши основные актеры, то наша роль - создать идеальное пространство для их проявления и свободного течения химических реакций.
Что представляет собой насыщенный раствор тиосульфата натрия и как он применяется?

- Тиосульфат натрия находит широкое применение в аналитической химии, особенно в процедурах титрования. Его способность к точному измерению концентрации ионов веществ и устойчивость к окислению делают его незаменимым веществом для проведения точных измерений и определений.
- Фотография также стала областью, где активно используется насыщенный раствор тиосульфата натрия. Он является необходимым компонентом в процессе переработки фотопленки, а также служит для удаления остатков химических веществ после фиксации снимков.
- В медицинских исследованиях тиосульфат натрия применяется в качестве антиоксиданта и антидота при отравлениях цианидами. Его способность связывать токсичные металлы и улучшать процессы детоксикации делает его необходимым средством в лечении отравлений и тяжелых металлов.
- Промышленность также нашла применение для тиосульфата натрия в различных производственных процессах. Он используется в гальваническом производстве, для удаления серы из дымовых газов и в качестве стабилизатора в химических реакциях.
Основные свойства и применение тиосульфата натрия в аналитической химии

Одним из основных свойств тиосульфата натрия является его способность взаимодействовать с ионами металлов различной степени окисления. Оно проявляется в виде большого числа реакций образования комплексов с ионами металлов, что позволяет использовать тиосульфат натрия в качестве стандартного вещества при титровании растворов, содержащих металлы.
Тиосульфат натрия также обладает способностью образовывать комплексы с различными органическими соединениями, включая противораковые препараты, аминокислоты и белки. Это делает его полезным реагентом в аналитической химии для определения содержания этих соединений в различных образцах.
| Применение в аналитической химии | Описание |
|---|---|
| Титрование окислителей | Тиосульфат натрия используется для определения содержания окислителей в растворах, таких как перманганаты и броматы, благодаря его сильным восстановительным свойствам. |
| Определение металлов | Тиосульфат натрия применяется в качестве стандартного вещества в процессе титрования растворов, содержащих металлы различной степени окисления, например медь, железо или свинец. |
| Комплексообразование с органическими соединениями | Тиосульфат натрия может образовывать комплексы с различными органическими соединениями, что позволяет его использование в анализе содержания противораковых препаратов, аминокислот и белков. |
Таким образом, тиосульфат натрия является важным реагентом в аналитической химии благодаря своим уникальным свойствам и широкому спектру применений. Его использование позволяет проводить точные и надежные анализы различных веществ, что делает его незаменимым инструментом в лаборатории.
Необходимые принадлежности и реагенты для приготовления раствора тиосульфата натрия с концентрацией 0.1 н
Для успешного приготовления раствора тиосульфата натрия с концентрацией 0.1 н необходимо иметь под рукой определенное оборудование и реагенты. В данном разделе руководства мы рассмотрим, что именно понадобится для проведения этой процедуры.
Одним из основных инструментов, которые потребуются для приготовления раствора тиосульфата натрия, является мерная посуда. Для точности измерений рекомендуется использовать стеклянные пробирки различных объемов. Кроме того, потребуется пипетка для точного дозирования реагентов.
Следующим важным компонентом является химический реагент - натрия тиосульфат. Он может быть приобретен в химических магазинах или онлайн-поставщиках. Для приготовления раствора с концентрацией 0.1 н, необходимо следить за правильной массой или объемом реагента, чтобы достичь желаемой концентрации.
Другой важный компонент - вода. Для приготовления раствора следует использовать дистиллированную воду, поскольку она обычно содержит меньше примесей, которые могут повлиять на точность результата. Также для измерения объема воды потребуется мерная колба или пробирка.
Дополнительными инструментами, которые могут пригодиться, являются весы для измерения массы реагентов и термостат для поддержания определенной температуры раствора.
В итоге, для успешного приготовления раствора тиосульфата натрия 0.1 н, необходимо обладать следующими предметами: мерная посуда (пробирки, пипетка, мерная колба), натрия тиосульфат, дистиллированная вода, весы и термостат (при необходимости).
Компоненты и подробные описания

В данном разделе представлен подробный список компонентов необходимых для приготовления стандартного раствора тиосульфата натрия с концентрацией 0.1 н. Вся информация представлена без использования конкретных определений, для более полного понимания процесса приготовления.
1. Вода: основной растворитель, используется для разведения других компонентов и обеспечения нужного общего объема раствора.
2. Тиосульфат натрия: химическое соединение, обладающее способностью восстанавливать окислители и используется в различных химических процессах.
3. Стандартный раствор титра: точно измеренное количество раствора, используется для определения концентрации других растворов или веществ путем титрования.
4. Индикатор: вещество, которое меняет цвет или состояние, указывая на окончание титрования или определенный показатель в химическом процессе.
5. Мерный сосуд: специальный сосуд с мерными делениями, используется для точного измерения объема жидкости.
6. Реакционная посуда: специальный сосуд, в котором проводятся химические реакции или измерения, обычно имеет удобную форму и объем.
7. Штатив с муфтой: конструкция, служащая для поддержки химической посуды и обеспечения удобного положения при проведении экспериментов.
8. Капельница: приспособление для капельного добавления растворов или веществ в реакционную посуду.
9. Лабораторные перчатки: средство индивидуальной защиты, предназначенное для защиты рук от химических веществ и других опасностей.
Все эти компоненты играют важную роль в процессе приготовления тиосульфата натрия 0.1 н из стандартного раствора титра. Их правильное использование и соответствие требованиям обеспечат точность и надежность получаемого раствора.
Порядок формирования раствора с накаливанием тиосульфата натрия концентрацией 0.1 н
В данном разделе представлен подробный порядок действий для получения источника раствора с определенной концентрацией тиосульфата натрия. Для эффективного процесса удалены все лишние детали, оставив только самое важное и актуальное.
- Определение необходимого количества сырья для получения требуемой концентрации раствора.
- Подготовка аккуратно очищенной посуды для проведения процесса синтеза.
- Тщательное растворение соответствующей массы твердого вещества в дистиллированной воде с помощью мешалки или взбалтывания.
- Перенос полученного раствора в сосуд большего объема, чтобы обеспечить удобный процесс накаливания.
- Осторожное нагревание раствора с постоянным контролем температуры для удаления примесей и получения стабильной концентрации. Важно избегать интенсивного кипения.
- Охлаждение раствора до комнатной температуры, поскольку излишнее нагревание может повредить структуру частиц и привести к нежелательным реакциям.
- Доведение объема раствора до необходимого значения, дополнительным добавлением дистиллированной воды, с использованием мерной пипетки для точного контроля.
- Тщательное перемешивание полученного раствора для равномерного распределения частиц.
При соблюдении всех указанных шагов, можно успешно приготовить раствор тиосульфата натрия с концентрацией 0.1 н. Этот раздел поможет вам узнать все необходимые детали и навыки, чтобы провести данный процесс эффективно и безопасно. Помните, что точность в каждом этапе играет важную роль в достижении стандартных результатов и успешного выполнения последующих экспериментов.
Описание последовательности действий и рекомендации

В данном разделе мы рассмотрим подробный алгоритм действий для получения раствора тиосульфата натрия заданной концентрации. Важно проявлять осторожность и точность на каждом этапе приготовления, чтобы достичь нужного результата.
Шаг 1: Подготовка оборудования и рабочей среды. Убедитесь, что все необходимые материалы и приборы находятся в исправном состоянии. Очистите и промойте все стеклянные посуды, которые вы собираетесь использовать. Подготовьте необходимое количество дистиллированной воды.
Шаг 2: Взвешивание тиосульфата натрия. Точное взвешивание тиосульфата натрия является ключевым аспектом получения раствора нужной концентрации. Отвесьте требуемое количество тиосульфата натрия, используя точные весы, и переложите в чистую сухую колбу.
Шаг 3: Растворение тиосульфата натрия. Добавьте небольшое количество дистиллированной воды в колбу с тиосульфатом натрия и аккуратно перемешайте содержимое, чтобы распределить тиосульфат по всей поверхности воды. Постепенно добавляйте оставшуюся дистиллированную воду, продолжая перемешивание, пока все тиосульфат натрия полностью не растворится.
Шаг 4: Концентрация и регулировка pH. Используя соответствующие реагенты и приборы, определите концентрацию полученного раствора тиосульфата натрия и проверьте pH-значение. Если нужно, внесите необходимые корректировки, чтобы достичь требуемой концентрации и pH.
Шаг 5: Хранение и маркировка. Перелейте полученный раствор в стеклянные флаконы или другую подходящую емкость и тщательно закройте. Не забудьте надписать маркировку на каждой емкости, указав название и концентрацию раствора.
Следуя этим рекомендациям и последовательности действий, вы сможете приготовить раствор тиосульфата натрия необходимой концентрации, готовый для использования в дальнейших экспериментах или анализах.
Проведение стандартной титровки с использованием раствора тиосульфата натрия 0.1 н
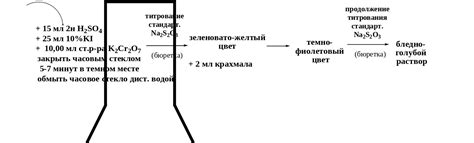
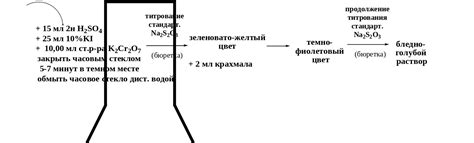
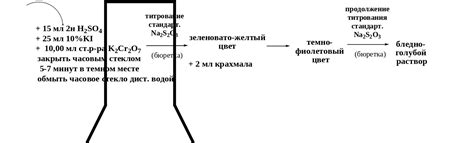
Для проведения данной титровки потребуется подготовить три основных компонента: раствор тиосульфата натрия, раствор индикатора и раствор титранта. Раствор тиосульфата натрия 0.1 н является основным реагентом, используемым в данной титровке. Данный реагент содержит натриевые и тиосульфатные ионы, которые взаимодействуют с анализируемым веществом.
- Приготовьте раствор тиосульфата натрия 0.1 н путем точного взвешивания соответствующей массы тиосульфата натрия и последующего растворения в дистиллированной воде.
- Для визуального определения окончания титровки необходимо приготовить раствор индикатора. Для данной титровки можно использовать крахмал в виде индикатора. Добавьте небольшое количество крахмала в дистиллированную воду, чтобы получить насыщенный раствор.
- В качестве титранта используется вещество, для которого известна концентрация и с которым взаимодействует анализируемое вещество. Для данной титровки можно использовать йодную кислоту в растворе.
При проведении стандартной титровки с использованием раствора тиосульфата натрия 0.1 н необходимо следить за точностью и аккуратностью выполнения операций. Титровка является точным методом определения концентрации веществ и требует строгое соблюдение всех этапов и условий. В конечном итоге, проведение стандартной титровки позволяет определить точную концентрацию анализируемого раствора с использованием раствора тиосульфата натрия 0.1 н.
Шаги и методика измерения концентрации с использованием стандартных растворов

- Подготовка образца: для начала необходимо подготовить образец, содержащий изучаемое вещество. Убедитесь, что образец чистый и не содержит посторонних примесей, которые могут искажать результаты измерений.
- Подготовка стандартных растворов: используя стандартные вещества, необходимо приготовить ряд растворов с известной концентрацией. В данном случае мы использовали тиосульфат натрия концентрацией 0.1 н, однако подобная методика широко применима и для измерений других веществ.
- Калибровка аналитического оборудования: перед проведением анализа необходимо откалибровать используемое оборудование, так как даже небольшие погрешности могут существенно влиять на точность результатов. Для этого используется стандартный раствор, и проводятся необходимые коррекции на основе полученных значений.
- Проведение эксперимента: после подготовки образца и стандартных растворов, можно приступить к измерениям. В данном случае, измеряется величина, связанная с концентрацией тиосульфата натрия. Для проведения эксперимента необходимо следовать протоколу и использовать соответствующие инструменты и реагенты.
- Обработка результатов: после проведения измерений, полученные данные подвергаются анализу и обработке. Это может включать в себя применение математических методов, статистических расчетов и корректировку погрешностей. Результаты измерений обычно представляются в виде графиков, таблиц и числовых значений.
Проведение измерения концентрации с использованием стандартных растворов является основным методом в химическом анализе. Представленный выше алгоритм позволяет систематизировать и стандартизировать процесс измерения, обеспечивая точные и надежные результаты. Это важный этап в проведении исследований и контроле качества в различных отраслях науки и промышленности.
Вопрос-ответ

Какой объем тиосульфата натрия нужно использовать для приготовления 0.1 н раствора?
Для определения объема тиосульфата натрия, необходимого для приготовления 0.1 н раствора, необходимо знать его концентрацию в стандартном титре и объем желаемого раствора. Вычисляется по формуле: V = (C * Vt) / N, где V - объем тиосульфата натрия, C - концентрация стандартного титра, Vt - объем желаемого раствора, N - стехиометрический коэффициент тиосульфата натрия. Результат вычислений будет в литрах.
Можно ли использовать обычную воду из-под крана для приготовления 0.1 н раствора тиосульфата натрия?
Рекомендуется использовать дистиллированную воду для приготовления 0.1 н раствора тиосульфата натрия. Обычная вода, взятая из-под крана, может содержать примеси и минералы, которые могут повлиять на точность определения концентрации раствора. Дистиллированная вода обладает более высокой чистотой и поможет в получении более точного результата.
Для чего используется тиосульфат натрия?
Тиосульфат натрия широко используется в химическом анализе, фотографии и в других промышленных процессах. В аналитической химии он используется в качестве вещества-тиранта для определения содержания различных веществ в растворах. В фотографии тиосульфат натрия используется для фиксации образа на пленке, удаляя остатки химических веществ, чтобы фотография стала устойчивой к свету.
Какие ингредиенты нужны для приготовления тиосульфата натрия 0.1 н из стандарт титра?
Для приготовления тиосульфата натрия 0.1 н из стандартного титра нужны следующие ингредиенты: чистый тиосульфат натрия, вода дистиллированная и калий йодид.
Как точно измерить нужное количество тиосульфата натрия для приготовления 0.1 н раствора?
Для точного измерения нужного количества тиосульфата натрия для приготовления 0.1 н раствора используйте аналитические весы. Поставьте пустой сухой чашку на весы, затем добавьте необходимое количество тиосульфата натрия, и снова взвесьте. Полученная масса будет являться необходимым количеством вещества.
Как правильно хранить приготовленный раствор тиосульфата натрия 0.1 н из стандартного титра?
Приготовленный раствор тиосульфата натрия 0.1 н нужно хранить в плотно закрытой стеклянной бутылке или флаконе. Рекомендуется хранить его в прохладном и темном месте, чтобы предотвратить разложение вещества под воздействием света и тепла. Также следует защитить раствор от прямого контакта с воздухом, чтобы избежать окисления и потери концентрации.