Орбитали – это бесконечно множественные сверхмикроскопические конструкты, играющие важную роль в процессах химических превращений. Они представляют собой наборы электронов, расположенных в особых областях пространства вокруг атомных ядер.
Главная задача орбиталей заключается в формировании связей между атомами, что полностью определяет структуру и свойства химических соединений. Используя электронное облако, орбитали обеспечивают эффективный обмен электронами, что отражается на реакционных способностях вещества.
Процесс формирования орбиталей является результатом сложных квантово-механических взаимодействий между электронами и атомными ядрами. Замечательно, что орбитали способны принимать различные формы и обладают уникальными энергетическими уровнями. Их состав, ориентация и число определяются правилами заполнения электронами, которые взаимодействуют между собой в соответствии со своими внутренними электронными конфигурациями.
Орбитали: концепция и механизм образования в химических процессах

Орбитали создаются в результате соперничества притягивающих и отталкивающих сил, включая ядро атома и другие электроны. Эти структуры имеют несколько форм и ориентаций, которые описывают возможные местоположения электронов. Интересно отметить, что орбитали имеют различные энергетические уровни и могут быть заполнены только определенным числом электронов.
Образование орбиталей в химических процессах происходит благодаря взаимодействию электронов в атомах и молекулах. Это взаимодействие приводит к образованию молекулярных орбиталей, которые охватывают области пространства между атомными ядрами. Созданные орбитали в молекуле влияют на ее структуру, связь и реакционную активность. Они образуются как результат перекрывания атомных орбиталей при образовании химической связи.
Таким образом, орбитали являются важным инструментом для понимания и предсказания химических процессов. Изучение их концепции и механизма образования помогает углубить наше понимание химии и развить методы контроля химических реакций.
Фундаментальные концепции и базовые принципы орбиталей

Изучение орбиталей позволяет осознать, как электроны взаимодействуют с другими атомами и молекулами в химических реакциях, определяя их свойства и реакционную способность.
Орбитали - это не просто концептуальные модели, они обладают определенными характеристиками и обуславливают основные правила квантовой теории для понимания строения вещества и его свойств.
- Различные типы орбиталей: Существуют несколько видов орбиталей, таких как s-орбитали, p-орбитали, d-орбитали и f-орбитали. Каждый тип орбитали имеет уникальную форму и энергию, определяющую распределение электронной плотности вокруг атомного ядра.
- Квантовые числа: Для описания орбиталей используются квантовые числа, такие как главное квантовое число, орбитальное квантовое число, магнитное квантовое число и спиновое квантовое число. Эти параметры определяют энергетический уровень и ориентацию орбиталей в пространстве.
- Заполнение орбиталей электронами: Для построения электронной конфигурации атома необходимо рассматривать принцип заполнения орбиталей. Согласно правилу Паули и принципу перестройки, электроны заполняют орбитали начиная с наименьшей энергии.
- Многоэлектронные атомы: Сложность многоэлектронных атомов связана с взаимодействием электронов разных орбиталей и их уровней энергии. Объяснение этого взаимодействия требует использования концепции индуцированных диполей и эффективного заряда ядра.
Понимание основных понятий и принципов, связанных с орбиталями, позволяет расширить знания о химической структуре вещества и предоставляет фундаментальную базу для объяснения многих химических явлений и реакций.
Орбитали и их формирование в химических превращениях
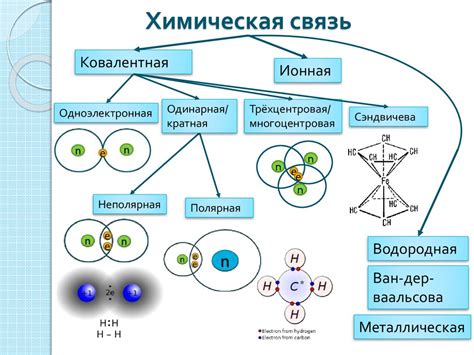
В данном разделе рассмотрим сущность процесса образования орбиталей в химических превращениях. Будет представлена общая идея этого явления, без привлечения специфических терминов и определений. Поговорим о том, как атомы и молекулы обмениваются электронами, образуя орбитали, которые играют важную роль во множестве химических реакций.
Вопрос-ответ

Что такое орбитали и как они участвуют в химических реакциях?
Орбитали - это пространственные зоны, в которых существует наибольшая вероятность обнаружить электроны атомов. Они играют ключевую роль в химических реакциях, так как взаимодействие орбиталей различных атомов определяет образование и разрыв химических связей.
Какие правила существуют при создании орбиталей в химических реакциях?
Существуют несколько основных правил. Во-первых, каждая орбиталь может содержать не более двух электронов с противоположным спином (принцип Паули). Во-вторых, орбитали заполняются в порядке возрастания их энергии (принцип заполнения орбиталей). И, наконец, орбитали одного подуровня заполняются по принципу наименьшей энергии (правило Гунда).
Какие типы орбиталей существуют и каковы их особенности?
Существуют шесть типов орбиталей: s, p, d, f, g и h. Орбитали типа s сферические, имеют форму шара и могут содержать два электрона. Орбитали типа p имеют форму двояковогнутой фигуры и могут содержать до шести электронов. Орбитали типа d имеют более сложную форму и могут содержать до десяти электронов. Остальные типы орбиталей имеют еще более сложные формы и могут содержать большее количество электронов.
Как орбитали влияют на свойства химических элементов и соединений?
Орбитали влияют на свойства химических элементов и соединений, так как они определяют качественные и количественные характеристики химических связей. Расположение электронов в орбиталях влияет на энергию связей и, следовательно, на стабильность вещества. Кроме того, орбитали определяют форму молекулы и ее реакционную способность.